产品中心
PRODUCT CENTER

低表达量His标签蛋白质纯化试剂盒。
|
货号 |
产品名称 |
产品规格 |
|
|
|
MHQ101 |
BcMag公司™ 低表达His标签蛋白纯化试剂盒 |
5毫升 |
|
|
|
MHQ102 |
BcMag公司™ 低表达His标签蛋白纯化试剂盒 |
10毫升 |
|
|
产品属性 |
|
|
组成 |
表面连接有 Ni2+的磁珠 |
|
磁力大小 |
~60 EMU/g |
|
磁化类型 |
超顺磁性 |
|
稳定性 |
适用于pH 4-11,100%乙醇,100%甲醇,8M尿素,6M盐酸胍, 20 mM DTT, 20mM EDTA |
|
浓度 |
100 mg/ml (1% NiSO4.6H2O) |
|
结合能力 |
>2mg His-标签 GFP /ml 磁珠 |
|
储存 |
储存在 4°C |
运输条件: 常温运输
储存条件: 在4ºC储存试剂盒。
BcMag ™ 低表达量His标签的蛋白质纯化试剂盒使用还原试剂兼容的磁珠纯化His标记的蛋白质,这些蛋白质可能存在有非特异性结合问题,例如低表达蛋白质或靶蛋白与细胞蛋白质结合(图1)。磁珠是使用纳米级超顺磁性氧化铁作为核心制造的,并完全由高纯度二氧化硅外壳包裹,确保氧化铁没有浸出问题。我们专有的螯合剂固定在其表面上,并与Ni2+离子牢固结合,从而对还原剂产生高抗性。由于二氧化硅材料产生的侧链比其他固体基质如琼脂糖要少很多,因此纯惰性二氧化硅产生的非特异性结合较少。此外,磁珠结合了BcMag ™ 低表达His标记的蛋白质纯化试剂盒的所有优点(低成本,简单,高特异性和容量)和磁性,可进行有效的手动或自动快速高通量纯化。
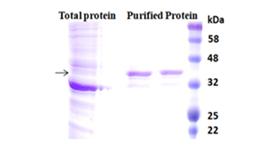
工作流程(图2)
用磁珠进行纯化很简单(图2)。将磁珠与样品混合,并连续旋转孵育足够的时间。在混合过程中,磁珠保持悬浮在样品溶液中,使目标分子与固定化配体相互作用。孵育后,收集磁珠并使用磁力架将其与样品分离。然后用咪唑洗脱超纯His标记的重组蛋白。
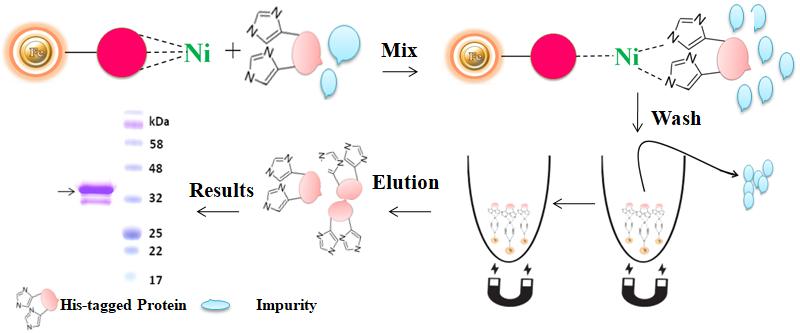
优势及特点
l 磁珠表现出比多孔载体更少的非特异性结合率。
l 稳定的共价键,最少的配体泄漏
l 在含有高达20mM EDTA和20mM还原试剂的情况下,磁珠不会发生镍离子浸出现象。
l 与细胞培养基中过量表达、或分泌蛋白的纯化兼容。
l 极高的蛋白纯度
l 性价比高:无需使用纯化柱、过滤器、有机试剂或进行重复移液。
l 高通量:与许多不同的自动化液体处理系统兼容。
产品应用
l 研究蛋白质结构和功能
l X射线晶体学的重组蛋白的制备
l 是研究蛋白质,与蛋白质或DNA相互作用的理想选择材料
l 在免疫研究中,提高抗体与对应蛋白的结合和能力
l 即使使用粗细胞裂解液,也能有效筛选出表达的蛋白质
l His标签蛋白的微量纯化
背景信息
背景信息
多聚组氨酸标签,也称为6xHis标签,和His标签,是从各种表达系统(包括细菌、酵母、植物细胞和哺乳动物细胞系统)中纯化重组蛋白的通用工具。该标签是位于重组蛋白的N或C末端的包含六个或更多个连续组氨酸的残基。由于这个氨基酸链体积非常小,His标签具有几个独特的特性,包括较少的免疫原性、亲水性以及可在天然和变性条件下都可发挥作用的用途广泛性。此外,不需要从重组蛋白上切割标签,因为它不会干扰其融合蛋白的结构和功能。His标签的纯化原理基于固定化金属离子亲和层析(IMAC)。
固定化金属离子亲和层析(IMAC)是一种快速的亲和纯化层析技术,是基于携带his标签的重组蛋白质对Ni2+或Co2+的亲和力从而达到分离目的,而Ni2+或Co2+则被结合固定到固相基质表面,例如珠状琼脂糖或纯化柱。在pH 7-8时,His标签蛋白将与Ni2+或Co2+结合。His标签重组蛋白质的结合反应受到各种自变量的影响,如pH、温度、盐类型、盐浓度、固定化的金属和配体密度以及蛋白质大小。可通过降低pH梯度、增加咪唑浓度或在缓冲液中加入EDTA螯合剂来洗脱结合的蛋白质。该技术是快速、直接捕获和纯化带标签重组蛋白的,高性价比的理想工具。
非特异性结合是从各种表达系统中纯化his标签蛋白的潜在问题,尤其是从低表达的重组his标签蛋白或与其他细胞蛋白相互作用的高表达蛋白中纯化his标签蛋白。许多因素可能导致非特异性结合。其中,低表达蛋白或与内源蛋白结合的标记蛋白可能导致严重的非特异性结合。His标签的蛋白质与IMAC的金属离子的结合取决于电荷。当树脂的his标签结合位点由于其低丰度而仅部分结合目标蛋白质时,会发生非特异性结合。其余的结合位点与其他带轻微电荷的蛋白质(如富含组氨酸的蛋白质)发生非特异性相互作用,导致纯化出的蛋白出现杂质。许多证据表明,在结合和洗涤缓冲液中还原试剂和非离子洗涤剂可以显着降低高度非特异性结合,并获得更纯净的蛋白质。IMAC应用中最常用的螯合剂是亚氨基二乙酸酯(IDA)或氮基三乙酸(NTA)。这些螯合剂不能与还原剂如DTT(二硫苏糖醇),β-me(β-巯基乙醇)和TCEP(三(2-羧乙基)膦)一起使用,因为还原剂可以从这些树脂中剥离金属,导致蛋白质结合能力的快速丧失。
此外,这些螯合剂主要固定在传统的亲和色谱基质上,如琼脂糖树脂或色谱柱。这些固体基质使纯化过程繁琐,耗时,无法处理非常微小的样品,并且难以适应自动化系统。Bioclone推出了一种功能强大的基于磁珠的IMAC系统来解决这些问题。
参考文献
1.Jansen, J-C. (Editor). (2011). Protein Purification: Principles, High-Resolution Methods, and Applications. 3rd edition. Volume 151 of Methods of Biochemical Analysis. John Wiley & Sons, Hoboken, NJ
2.Bornhorst, J.A. and Falke, J.J. (2000). Purification of Proteins Using Polyhistidine Affinity Tags. Methods Enzymol. 326: 245-254.
3.Spriestersbach A, Kubicek J, Schäfer F, Block H, Maertens B. Purification of His-Tagged Proteins. Methods Enzymol. 2015;559:1-15. doi: 10.1016/bs.mie.2014.11.003. Epub 2015 May 4. PMID: 26096499.
4.Zhang C, Fredericks D, Longford D, Campi E, Sawford T, Hearn MT. Changed loading conditions and lysate composition improve the purity of tagged recombinant proteins with tacn-based IMAC adsorbents. Biotechnol J. 2015 Mar;10(3):480-9. doi: 10.1002/biot.201400463. Epub 2014 Oct 31. PMID: 25303209.
5.Pina AS, et al. (2014) Affinity tags in protein purification and peptide enrichment: An overview. Methods in molecular biology (Clifton, N.J.) 1129: 147-168.
6.Young CL, et al. (2012) Recombinant protein expression and purification: A comprehensive review of affinity tags and microbial applications. Biotechnol J 7(5): 620-634.