产品中心
PRODUCT CENTER

可分离式甲苯磺酰基磁珠
|
货号 |
产品名称 |
产品规格 |
价格(美元) |
订单 |
|
IR101 |
1µm BcMag™可分离式甲苯磺酰基磁珠 |
150 mg |
375 |
|
|
IR102 |
1µm BcMag™可分离式甲苯磺酰基磁珠 |
300 mg |
650 |
|
|
IR103 |
2.5µm BcMag™可分离式甲苯磺酰基磁珠 |
150 mg |
375 |
|
|
IR104 |
2.5µm BcMag™可分离式甲苯磺酰基磁珠 |
300 mg |
650 |
|
|
如需大量订购,请联系我们报价! |
||||
|
产品属性 |
||
|
组成 |
表面连接有高密度可分离式甲苯磺酰基的磁珠 |
|
|
磁珠数量 |
约1.68 x 109磁珠/毫克(1um磁珠) 约5 x 107磁珠/毫克(5um磁珠) |
|
|
稳定性 |
短期(<1小时):pH 3-11;长期:pH 4-10 温度:4°C-140°C;大多数有机溶剂 |
|
|
磁力大小 |
40-45 EMU/g |
|
|
磁化类型 |
超顺磁性 |
|
|
状态 |
冻干粉 |
|
|
官能团密度 |
1µm磁珠 |
约245μmole/g磁珠 |
|
2.5µm磁珠 |
约230μmole/g磁珠 |
|
|
存储 |
收到后储存在-20℃ |
|
BcMagTM可分离式甲苯磺酰基活化磁珠是表面覆盖有高密度甲苯磺酰基官能团的二氧化硅基质的磁珠。甲苯磺酰基活化磁珠可以在不引入任何电荷的情况下,在水或有机溶剂(30%DMF)中有效地共价结合含有伯胺基的配体。因为活性醛基基团通过内置的可切割二硫键连接物(图1)与磁珠连接,因此,可用还原剂(如DTT或β-巯基乙醇)从磁珠上切割并分离出目标分子-配体的复合物。可分离式甲苯磺酰基磁珠是结合大分子蛋白和多肽的理想选择。
甲苯磺酰基活化磁珠是将抗体,多肽,完整蛋白质和功能酶共价连接到磁珠表面的理想选择。固定化的磁珠由于其低背景和抗体与磁珠表面的共价结合,而广泛用于蛋白质和蛋白质复合物的免疫沉淀。
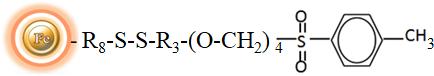
甲苯磺酰基活化磁珠偶联反应在37℃下进行,pH范围在偏碱性环境。我们建议在pH 8.5-9.5下偶联,但与高pH不稳定配体的偶联可以在pH 7.4的替代缓冲液中进行。
产品独特的干燥状态避免了丙酮溶剂储存的麻烦,或液体去除和处理的需要。此外,由于干基质在膨胀时浓缩样品,减少了起始材料的体积,并且会提高配体固定化的效率,因此它非常适合与浓度较低样品进行偶联反应。
工作流程
本磁珠作为固体载体可以完美地用于各种亲和纯化,将分子,细胞和部分细胞进行纯化。只需要与配体结合后,将磁珠添加到含有目标分子的溶液中,然后混合,孵育,清洗和洗脱目标分子(图2)
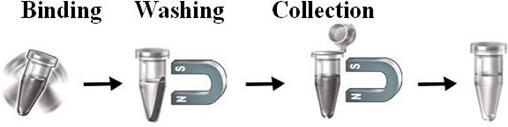
特点和优势:
l 预活化,即用型磁珠
l 含有一个可切割的内置二硫键,可将配体-目标分子复合物从磁珠中分离出来。
l 便于使用
l 结和后表面不会带电荷
l 稳定的共价键,低水平的配体泄漏
l 可重复使用的免疫亲和基质
l 极低的非特异性结合率
l 可固定1-10mg蛋白或0.1-1mg多肽/ml的磁珠
l 用途:用于纯化抗体,蛋白质/肽,DNA / RNA;细胞筛选、免疫沉淀
操作过程
提示:
l 强烈建议在实验过程中进行滴定优化,以确定每个实验中应用的磁珠数量。该协议可以相应地放大和缩小。
l 避免使用含有还原剂、tris或其他含有伯胺或其他亲核类试剂的缓冲液,因为它们会破坏二硫键连接物或与预期的偶联反应竞争。但wash buffers和 storage buffers 可含有氨基或羧基成分。
所需耗材
1.磁力分离器(适用于手动操作):根据实验时生物样品的体积,使用者可以选择一下不同型号的磁力分离器:
BcMag™ separator-2可以容纳两个单独的1.5 ml离心管(Cat.# MS-01);
BcMag™ separator-6可以容纳六个单独的1.5 ml离心管(Cat.# MS-02);
BcMag™ separator-24可以容纳24个单独的1.5-2.0 ml离心管(Cat.# MS-03);
BcMag™ separator-50可以容纳一个单独的50 ml离心管,一个15ml的离心管,以及四个1.5ml离心管(Cat.# MS-04);
BcMag™ separator-96 可以配合96 ELISA板使用 (Cat.#MS-05).
2.Coupling Buffer: 0.1 M磷酸钠缓冲液,pH 7.4
提示:
l coupling buffers应具有最小的离子强度,且不应含有任何具有氨基(如Tris)的成分。但wash buffers 或者storage buffers可含有氨基或羧基。
l 水不溶性配体可以在含有30%有机溶剂(30%DMF)的coupling buffers中结合。
3. Blocking Buffer: PBS pH 7.4 含有 0.5% (w/v) BSA
4. Washing buffer: PBS pH 7.4含有 0.1% (w/v) BSA
A.磁珠的准备
1.用100%异丙醇制备3%的磁珠(30 mg/ml),并充分混合。
提示:将未使用的磁珠可以在异丙醇溶液中,储存在4℃。可保存一年时间。
2.将100µl(3mg)的磁珠转移到离心管中。
3. 将试管放在磁力分离器上1-3分钟。当磁珠完全沉淀时,去除上清液。从磁力分离器上取下试管,加入1ml的coupling buffer用通过涡旋30秒重新悬浮磁珠。
4.重复步骤3 两次。
5.去除上清液,将清洗的磁珠准备进行耦合反应。
注:使用coupling buffer重新水化后,由于官能团的稳定性,应尽快使用磁珠。
B.蛋白质结合
1.用coupling buffer制备100µl蛋白质溶液(0.5-1mg/ml)或多肽溶液(200μmol/ml)。
提示:偶合效率因配体而异。用户可应根据经验优化配体的浓度。
2. 将蛋白质或者多肽溶液与上述清洗过的磁珠混合,通过涡旋或者吹吸的方式。
3. 孵育反应,在20-25℃温度下偶合至少需要24-48小时。在4℃下耦合时,培养时间
应至少延长至48-72小时。
4. 用1ml的washing buffer将磁珠洗涤3次。
5. 向磁珠中添加1ml的blocking buffer,并在室温下孵育1小时或4℃过夜。
6. 用1 ml的PBS洗涤磁珠4-6次。
7. 用含有0.1%叠氮化物(w/v)的PBS缓冲液重新悬浮磁珠至所需浓度,在
4°C下储存,直至使用。不要冷冻保存。
C.常见亲和纯化过程
提示:
l 该方案是一个通用的亲和纯化发法。因为没有两种蛋白质是完全相同的,所以不可能为所有的蛋白质纯化设计一个通用的协议。为了获得最佳结果,每个用户必须确定纯化单个目标蛋白的最佳工作条件。
l 避免在binding buffers 和 washing buffers中使用还原剂。
l 强烈建议根据粗样品中目标蛋白质的含量,进行滴定,以优化每个单独实验
中使用的磁珠数量。使用过多的磁珠将导致较高的背景,而使用过少的磁珠将导致较低的产量。每毫克磁珠通常可与1-20μg靶蛋白结合。
1.将适量的珠子转移到离心管中。将管放在磁力分离器上1-3分钟。当磁珠完全沉淀时,去除上清液。
2. 取下试管,加入5倍磁珠溶液体积的PBS缓冲液,通过震荡重新悬浮磁珠,涡旋30
秒。将试管至于室温环境1-3分钟,再将管放在磁力分离器上1-3分钟。当磁珠完全
沉淀时,去除上清液。
3.重复步骤2 两次。
4. 向含有目标蛋白质的粗样品中添加洗涤过的磁珠,并在室温或所需温度下温浴1-2小
时(温度越低,培养时间越长)。
提示:强烈建议进行滴定实验以优化培养时间。因为孵化的时间太长可能会导致很高的背景。
5. 用5倍磁珠体积的PBS缓冲液或1M NaCl彻底清洗磁珠,直到280nm处洗脱液的吸光度接近背景水平(OD 280<0.05)。
提示:添加更高浓度的盐、非离子洗涤剂和还原剂也可能会降低非特异性背景。例如,向洗涤缓冲液中添加NaCl(浓度为1-1.5 M)、0.1-0.5%的非离子洗涤剂,如Triton X-100或Tween-20,以及还原剂,如DTT或TCEP(我们通常使用3mM)。
6. 通过适当的方法,如低pH(2-4)、高pH(10-12)、高盐、高温、亲和洗脱或SDS-PAGE加载缓冲液中煮沸,洗脱目标蛋白。
7.切断二硫键
提升:由于配体之间的构象不同,用户应确定最佳工作条件,如还原剂、pH值和温度,以切割单个配体的二硫键。以下是从磁珠上切割共轭的GFP蛋白的示例。
1)在140 mMβ-巯基乙醇或5 mM DTT(二硫苏糖醇)中孵育磁珠(30mg/ml)。
a. 在 100 mM Tris-HCl, pH 8.0, 50 mM EDTA, 140 mM β-巯基乙醇条件下,室温2小时或
者过夜孵育,或者在98℃条件下5分钟。
b. 在100 mM Tris-HCl, pH 8.0, 50 mM EDTA, 5mM DTT条件下,室温2小时或者过夜孵
育,或者在98℃条件下5分钟。



